表觀遺傳是確保生物表型復(fù)雜性和多樣性的關(guān)鍵機(jī)制��。Rpd3是一類全局基因調(diào)控因子和共抑制因子�����,于1996年首次被報(bào)道作為組蛋白去乙酰化酶(HDAC)發(fā)揮作用�;這一發(fā)現(xiàn)與同年組蛋白乙酰轉(zhuǎn)移酶GCN5的轉(zhuǎn)錄共激活功能發(fā)現(xiàn)一起,標(biāo)志了現(xiàn)代表觀遺傳學(xué)的興起����。作為Class-I類型HDAC的原型代表,來自酵母的Rpd3可以形成Rpd3S(分子量0.6兆道爾頓)和Rpd3L(分子量1.2兆道爾頓)兩類多亞基酶分子機(jī)器��,能夠分別響應(yīng)H3K36me3或H3K4me3兩類上游組蛋白甲基化信號(hào)��,在不同染色質(zhì)功能區(qū)段(轉(zhuǎn)錄延伸區(qū)或啟始區(qū))介導(dǎo)組蛋白H3和H4去乙?�;磻?yīng)����,精密調(diào)控基因表達(dá)�����。研究表明����,人體中Rpd3S/L同源復(fù)合物Sin3B/A的功能異常與腫瘤����、心血管疾病等發(fā)生相關(guān),是重要的藥物開發(fā)靶點(diǎn)��。
Rpd3S介導(dǎo)的染色質(zhì)甲基化與乙?���;瘎?dòng)態(tài)調(diào)控
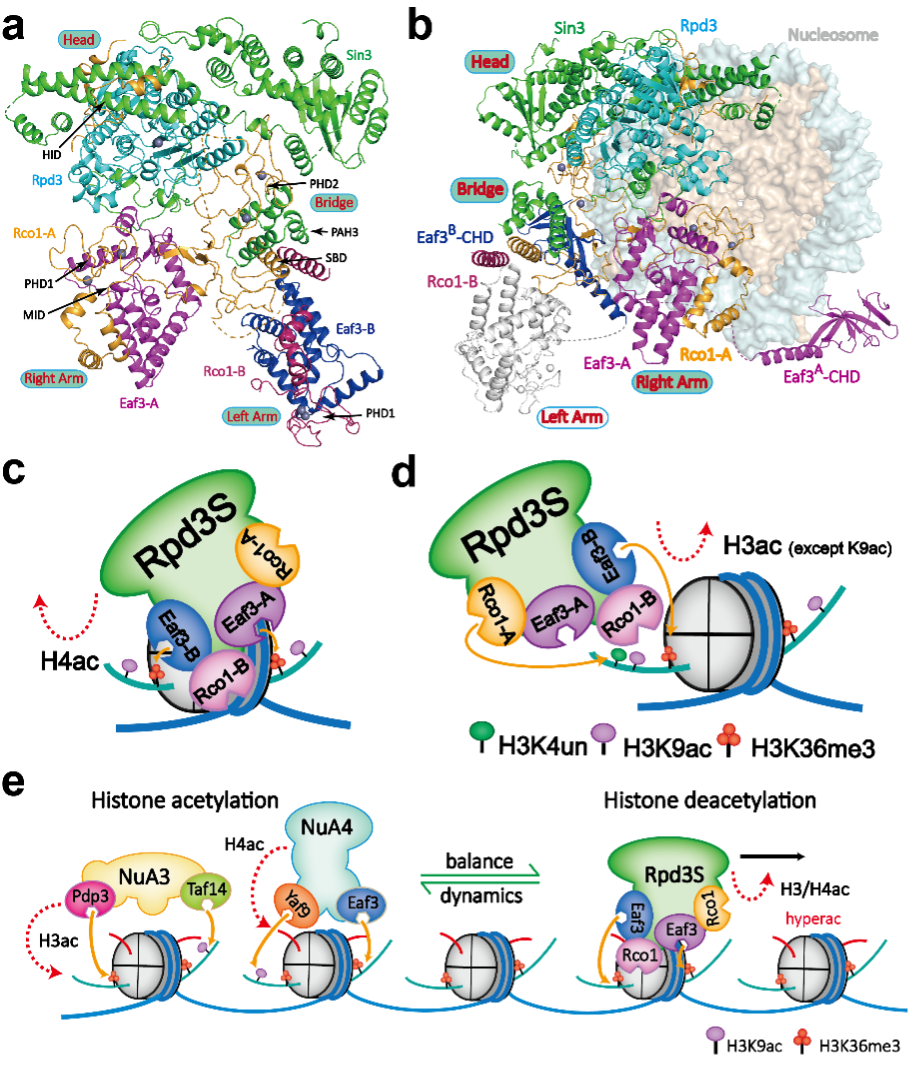
a. 組蛋白去乙酰化酶Rpd3S復(fù)合物的分子結(jié)構(gòu)基礎(chǔ)��;b. Rpd3S復(fù)合物H3K36me3修飾引導(dǎo)下核小體催化與調(diào)控分子模型���;c-d. Rpd3S在H3K4un和H3K36me3修飾引導(dǎo)下調(diào)控核小體組蛋白H4和H3去乙?�;^程機(jī)理����;e. Rpd3S催化保留的H3K9ac與H3K36me3共同作為 “種子” 參與招募乙酰化轉(zhuǎn)移酶NuA3/NuA4復(fù)合物促進(jìn)乙?���;目焖僦匦陆ⅰ?/p>
近日��,清華大學(xué)醫(yī)學(xué)院李海濤和生命學(xué)院閆創(chuàng)業(yè)合作團(tuán)隊(duì)在Rpd3S介導(dǎo)的染色質(zhì)去乙?��;瘎?dòng)態(tài)調(diào)控機(jī)制上取得重要突破��,相關(guān)成果以“Diverse modes of H3K36me3-guided nucleosomal deacetylation by Rpd3S”(組蛋白H3第36位賴氨酸三甲基化指引下的多模式Rpd3S核小體去乙?���;轭}����,于2023年7月19日在《自然》(Nature)雜志作為研究長文發(fā)表��。
首先�����,研究者利用化學(xué)生物學(xué)手段合成出性質(zhì)均一的修飾組蛋白并成功組裝出多種修飾組合類型的“人工設(shè)計(jì)”核小體。隨后���,通過單顆粒冷凍電鏡技術(shù)解析了釀酒酵母Rpd3S復(fù)合物在自由狀態(tài)和結(jié)合H3K36me3核小體狀態(tài)下的分子結(jié)構(gòu)模型����。進(jìn)而���,研究者以復(fù)合多修飾核小體為底物系統(tǒng)探究了Rpd3S復(fù)合物去乙?���;富畹奶禺愋?���,并利用酵母遺傳學(xué)等功能實(shí)驗(yàn)驗(yàn)證其調(diào)控模式。通過上述研究�����,研究者對(duì)Rpd3S復(fù)合物的組裝模式��、底物識(shí)別催化和修飾指引調(diào)控等過程進(jìn)行了全面的分子機(jī)制解剖�����。本研究揭示了Rpd3S復(fù)合物在識(shí)別核小體底物和甲基化介導(dǎo)的去乙酰化調(diào)控過程中的動(dòng)態(tài)和多樣化模型���,凸顯出表觀遺傳調(diào)控的復(fù)雜精妙性��,并展示了大自然通過形成多亞基大復(fù)合物來實(shí)現(xiàn)調(diào)控能力的精巧設(shè)計(jì)���。
該研究成果展示Rpd3S的獨(dú)特結(jié)構(gòu),其中兩個(gè)Eaf3-Rco1異源二聚體與Rpd3和Sin3不對(duì)稱地結(jié)合形成一個(gè)催化核心復(fù)合物�����。Eaf3����、Sin3和Rco1分別參與對(duì)于兩個(gè)H3K36me3修飾標(biāo)簽、核小體DNA和連接區(qū)DNA的多價(jià)識(shí)別�,將Rpd3的催化中心定位在組蛋白H4 氨基末端尾部附近進(jìn)行去乙酰化酶活��。在另一種催化模式中�,Rco1和Eaf3通過識(shí)別非修飾的組蛋白H3第4位賴氨酸(H3K4un)和H3K36me3修飾從而引導(dǎo)特異性的組蛋白H3 N-末端尾部的去乙?�;富睿瑓s特異性保留了組蛋白H3第9位的乙?����;嚢彼幔℉3K9ac)�。依托分子結(jié)構(gòu)模型、體外生化和體內(nèi)功能數(shù)據(jù)���,研究團(tuán)隊(duì)提出了H3K9ac和H3K36me3修飾可以作為“種子”修飾引導(dǎo)后續(xù)乙?�;D(zhuǎn)移酶的招募和快速H3/H4乙?;揎椫匦陆⒌臋C(jī)制�����。
在此項(xiàng)研究中��,清華大學(xué)醫(yī)學(xué)院李海濤課題組博士后管海鵬和已畢業(yè)博士生王沛為并列第一作者�。清華大學(xué)醫(yī)學(xué)院2020級(jí)博士生張沛主要參與了本研究,上海交通大學(xué)醫(yī)學(xué)院李兵教授��、阮純博士���,以及鄭州大學(xué)醫(yī)學(xué)科學(xué)院鄭向東特聘教授提供了專業(yè)指導(dǎo)和幫助�����。清華大學(xué)醫(yī)學(xué)院李海濤教授和生命學(xué)院閆創(chuàng)業(yè)副教授為共同通訊作者��。
該工作得到國家自然科學(xué)基金委員會(huì)�、國家重點(diǎn)研發(fā)計(jì)劃的資助。李海濤教授是清華-北大生命科學(xué)聯(lián)合中心�、北京生物結(jié)構(gòu)前沿研究中心、分子腫瘤學(xué)全國重點(diǎn)實(shí)驗(yàn)室����、教育部蛋白質(zhì)科學(xué)重點(diǎn)實(shí)驗(yàn)室,以及山西醫(yī)科大學(xué)-清華大學(xué)醫(yī)學(xué)院前沿醫(yī)學(xué)協(xié)同創(chuàng)新中心成員�。
論文鏈接:
https://www.nature.com/articles/s41586-023-06349-1
科研成果動(dòng)畫展示:
https://static-content.springer.com/esm/art%3A10.1038%2Fs41586-023-06349-1/MediaObjects/41586_2023_6349_MOESM7_ESM.mp4