曹濟民課題組:BaTiO3@Au納米異構體通過持續(xù)抑制線粒體能量代謝來抑制三陰性乳腺癌
背景介紹
三陰性乳腺癌(TNBC)由于其侵入性高�,缺乏有效的治療靶點,導致臨床轉(zhuǎn)移風險高�����,總生存率低����。最近的研究表明�����,TNBC具有特殊的代謝偏好���,代謝異常已成為高度惡性和浸潤性TNBC的潛在靶標���。但是,現(xiàn)有的代謝干預措施由于潛在的全身毒性����,代謝不穩(wěn)定性和有限的靶向能力導致治療效果不理想。因此��,如何有選擇性,并持續(xù)地阻斷腫瘤細胞的能量供應成為亟待解決的關鍵問題��。
成果簡介
為了突破這些局限���,山西醫(yī)科大學曹濟民課題組聯(lián)合新加披國立大學陳小元課題組開發(fā)了一種BaTiO3@Au核殼納米結(jié)構(BTO@Au)��,以選擇性和持續(xù)地阻斷腫瘤細胞的能量供應��。BTO@Au材料有效地統(tǒng)一了具有光熱性能的Au納米材料與熱釋電性能的BaTiO3納米材料���。該材料在近紅外區(qū)具有強的局域表面等離子體共振(LSPR)。在室溫條件下���,BTO的自發(fā)極化(Ps)場可以驅(qū)動Au的電子(e-)向界面移動����,補償BTO表面的h+���;同時����,BTO的e-可被環(huán)境中的h+屏蔽。在近紅外激光照射下���,LSPR介導的Au的光熱性能可以有效地提高BTO的溫度��,導致Ps場減小��,BTO表面釋放過多的h+和e-�,分別與H2O和O2反應生成HO?和?O2-���,顯著抑制線粒體氧化磷酸化(OXPHOS)并減少ATP產(chǎn)生以誘導TNBC細胞凋亡。體外和體內(nèi)研究都證實了BTO@Au在近紅外光下顯著的腫瘤抑制效果���,這表明干擾癌細胞的線粒體能量代謝是TNBC治療的有效策略����。該研究成果于2022年8月以“BaTiO3@Au nanoheterostructure suppresses triple-negative breast cancer by persistently disrupting mitochondrial energy metabolism”為題發(fā)表在NanoResearch(JCR Q1區(qū)���,IF=10.269)上����。
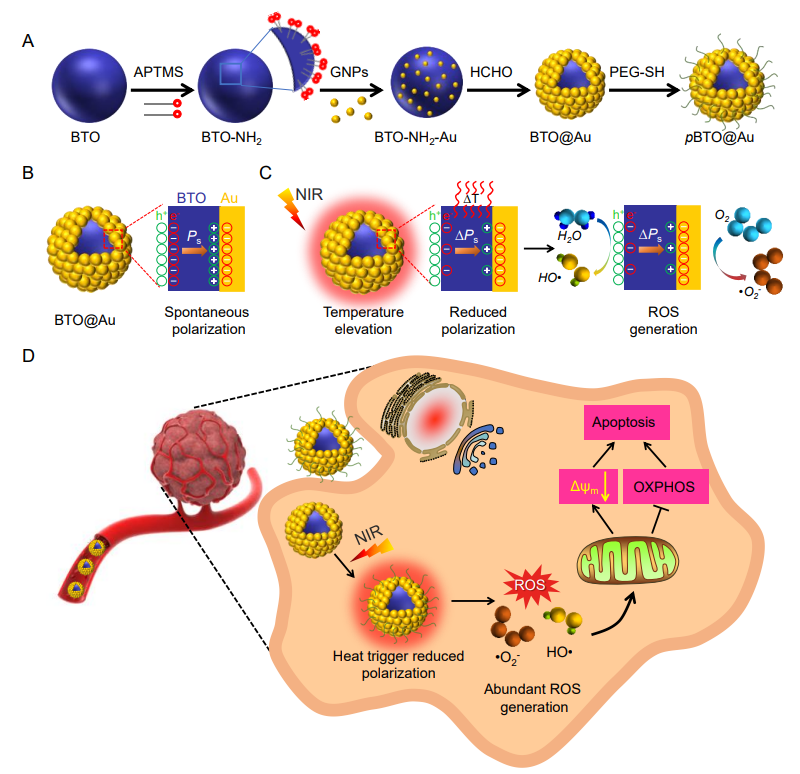
示意圖:BTO@Au納米材料的制備流程圖(A)�,在室溫條件(B)及近紅外光照射下(C)極化示意圖和破壞能量代謝以治療TNBC(D)示意圖。
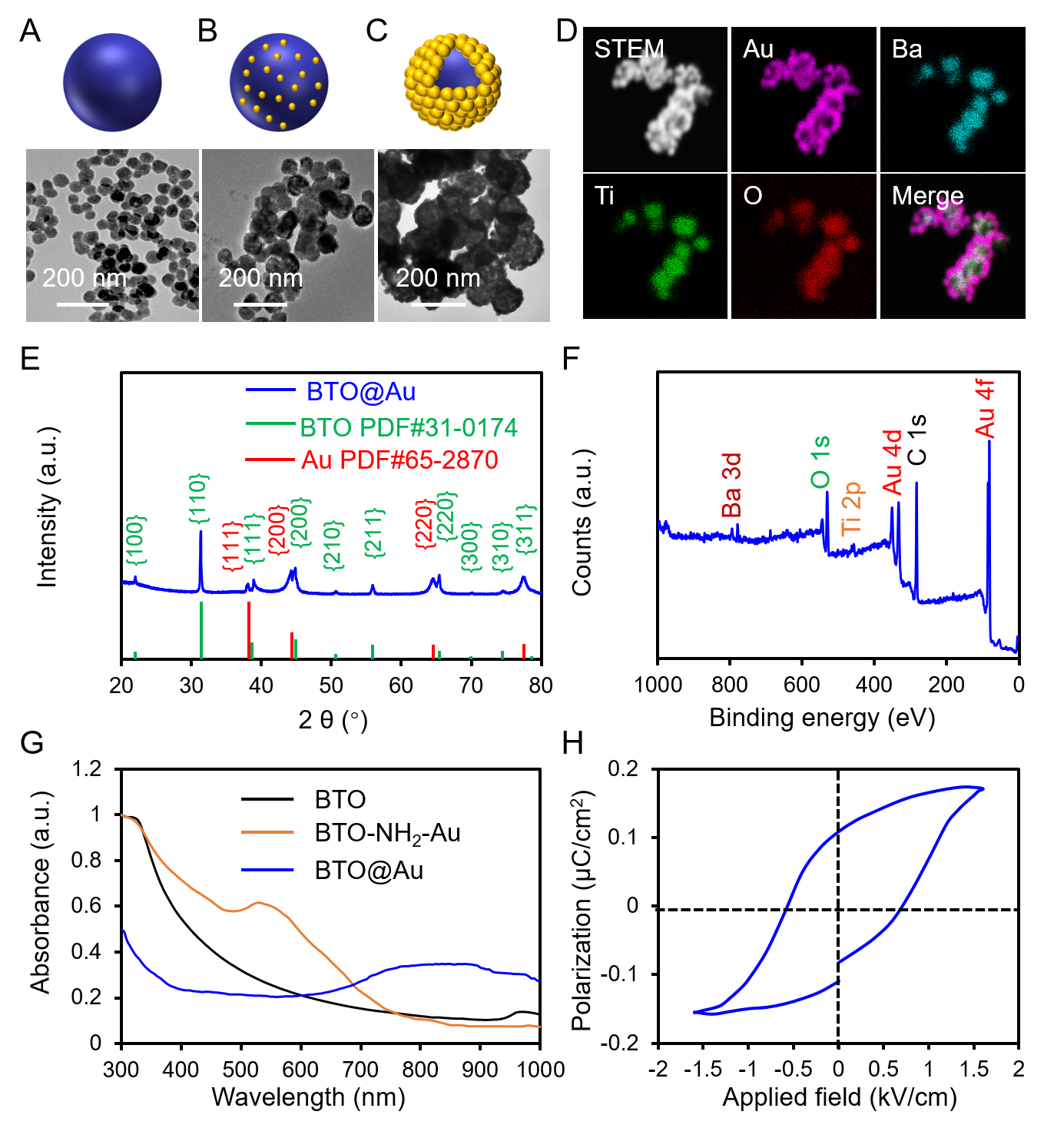
圖1 BTO@Au的理化性質(zhì)表征��。
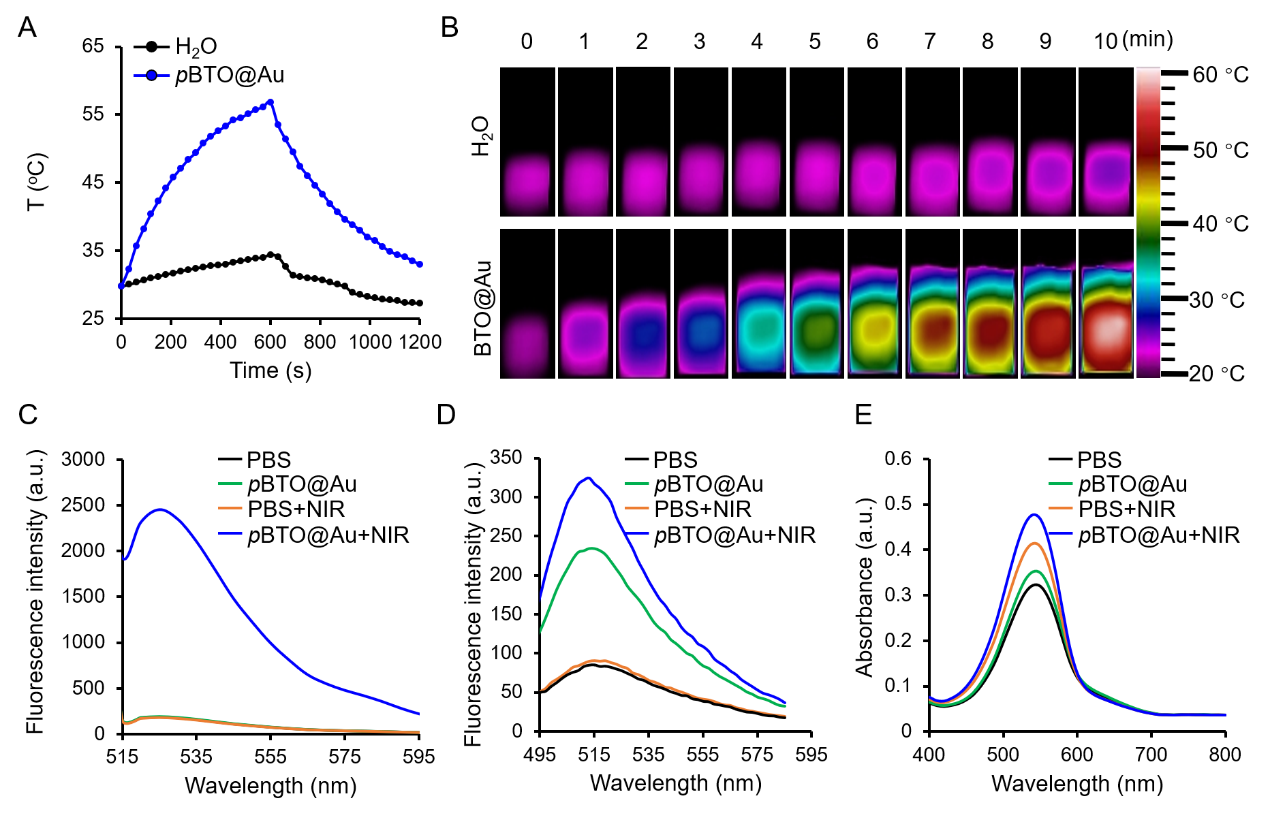
圖2 pBTO@Au的光熱及熱電性能表征。
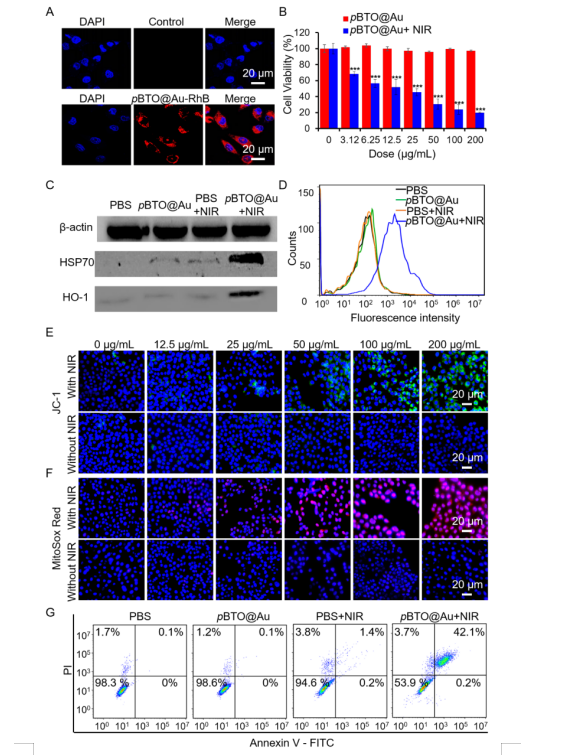
圖3 pBTO@Au在4T1細胞中的抗腫瘤作用及機理分析�。
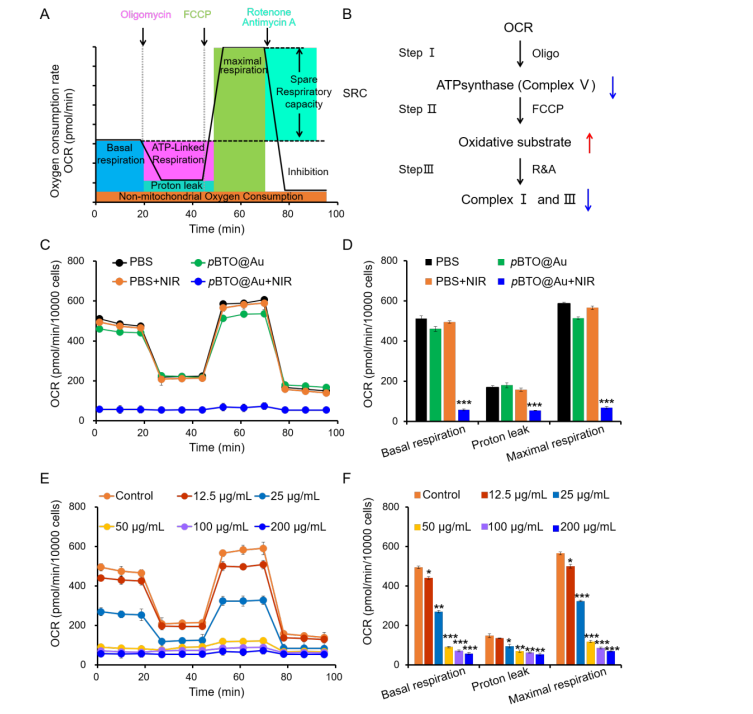
圖4 pBTO@Au對4T1細胞OXPHOS的抑制作用。
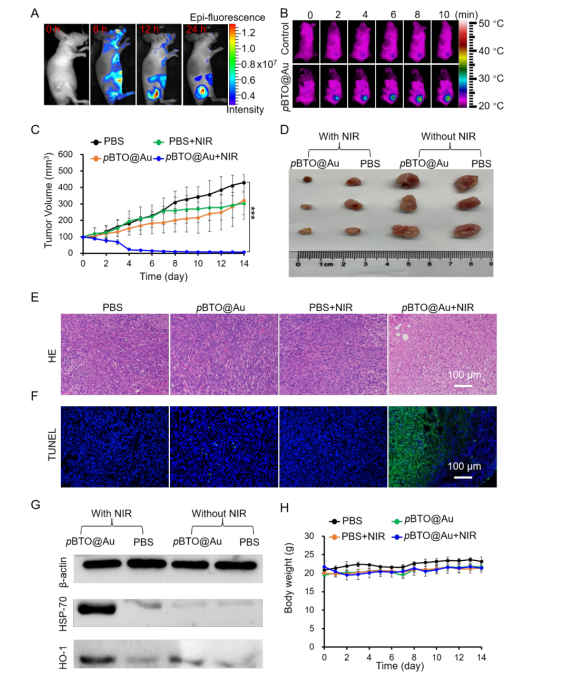
圖5 pBTO@Au在4T1荷瘤小鼠中的治療效果評價�。
山西醫(yī)科大學基礎醫(yī)學院曹濟民教授,新加坡國立大學陳小元教授和新加坡國立大學曹芳芳博士后是該論文的共同通訊作者��,山西醫(yī)科大學基礎醫(yī)學院馮艷林教授和山西醫(yī)科大學基礎醫(yī)學院碩士研究生王建霖是該論文的共同第一作者���。