骨髓間充質(zhì)干細(xì)胞通過抑制破骨相關(guān)因子和分化為軟骨細(xì)胞改善膠原誘導(dǎo)關(guān)節(jié)炎大鼠的骨侵蝕
類風(fēng)濕性關(guān)節(jié)炎(RA)以對稱性多關(guān)節(jié)炎為特征����,滑膜炎癥浸潤以及免疫細(xì)胞和滑膜成纖維細(xì)胞之間的相互作用最終導(dǎo)致軟骨和骨侵蝕�。傳統(tǒng)的類風(fēng)濕性關(guān)節(jié)炎藥物主要包括非甾體類抗炎藥和傳統(tǒng)改善病情抗風(fēng)濕藥物,這些藥物通常會引起胃腸道副作用��、腎損害��、骨髓抑制和心理障礙���。近年來對RA的研究進(jìn)展已經(jīng)闡明了炎癥��、自身免疫��、細(xì)胞因子網(wǎng)絡(luò)和各種細(xì)胞功能在RA發(fā)生和發(fā)病中的作用�。多種靶向抑制免疫細(xì)胞、細(xì)胞因子及其信號通路藥物的上市使許多難治性RA患者受益��。然而�,這類藥物僅針對RA發(fā)病的某一步驟,而且價(jià)格昂貴�����?���?梢鹱⑸洳课弧⒛[瘤及肺結(jié)核等傳染病的反應(yīng)�,停藥后易復(fù)發(fā)。此外�,大約30%的患者對這種治療沒有反應(yīng),臨床緩解的RA患者在影像學(xué)檢查時(shí)顯示進(jìn)行性關(guān)節(jié)糜爛����。因此�����,在RA的關(guān)節(jié)損傷后,關(guān)節(jié)糜爛不能通過藥物治療干預(yù)有效修復(fù)�,是進(jìn)行性關(guān)節(jié)損傷、繼發(fā)性骨關(guān)節(jié)炎和關(guān)節(jié)功能障礙的危險(xiǎn)因素�����。細(xì)胞��、組織和基因工程的進(jìn)步使得干細(xì)胞治療適合于類風(fēng)濕關(guān)節(jié)炎����。間充質(zhì)干細(xì)胞(MSCs)具有多能性,易于分離和擴(kuò)增�����,特別是分化為軟骨細(xì)胞����,具有免疫調(diào)節(jié)和抗炎功能。因此�,它們是修復(fù)RA患者關(guān)節(jié)損傷的理想治療方法。大量研究報(bào)道MSCs在RA中具有免疫調(diào)節(jié)作用;然而����,沒有研究報(bào)道MSCs植入RA患者或RA動物模型的命運(yùn)����。外用MSCs后�����,MSCs遷移�、歸巢到關(guān)節(jié)組織以及抑制大鼠骨破壞的機(jī)制尚不清楚。
因此�����,為明確骨髓MSCs(BMSCs)對RA動物經(jīng)典模型-CIA大鼠的干預(yù)作用����,并分析其發(fā)揮作用的具體機(jī)制,山西醫(yī)科大學(xué)第三臨床醫(yī)學(xué)院風(fēng)濕免疫科張莉蕓教授團(tuán)隊(duì)在大鼠體內(nèi)實(shí)驗(yàn)中研究了BMSCs對CIA大鼠的干預(yù)效果�,評估其關(guān)節(jié)炎指數(shù)、影像學(xué)及滑膜病理改變��;通過尾靜脈給藥綠色熒光蛋白(GFP)標(biāo)記的MSCs����,追蹤MSCs的遷移和歸巢��,并探討其抑制骨破壞的機(jī)制,為BMSCs在RA的臨床轉(zhuǎn)化應(yīng)用提供重要的理論和實(shí)驗(yàn)基礎(chǔ)�。該研究成果于2020年以“Bone marrow mesenchymal stem cells improve bone erosion in collagen-induced arthritis by inhibiting osteoclasia-related factors and differentiating into chondrocytes”為題發(fā)表于Stem Cell Research & Therapy上。
該研究結(jié)果顯示:
1����、大鼠BMSCs的分離、培養(yǎng)及鑒定
在標(biāo)準(zhǔn)培養(yǎng)條件下�����,大鼠骨髓間充質(zhì)干細(xì)胞粘附在塑料基質(zhì)上生長�����,呈現(xiàn)長紡錘狀形態(tài)(圖1A)����。流式細(xì)胞術(shù)分析BMSCs表面抗原表型顯示CD44、CD105和CD29表達(dá)����,而CD45、CD34和CD31不表達(dá)�。此外���,在誘導(dǎo)培養(yǎng)基中培養(yǎng)后,BMSCs在體外具有成脂��、成骨和成軟骨分化的潛力(圖1C-F)�����。此外�,熒光顯微鏡下,市售GFP標(biāo)記的MSCs的形態(tài)與我們實(shí)驗(yàn)室提取和培養(yǎng)的大鼠BMSCs相似��,細(xì)胞顯示綠色熒光信號(圖1B)�。
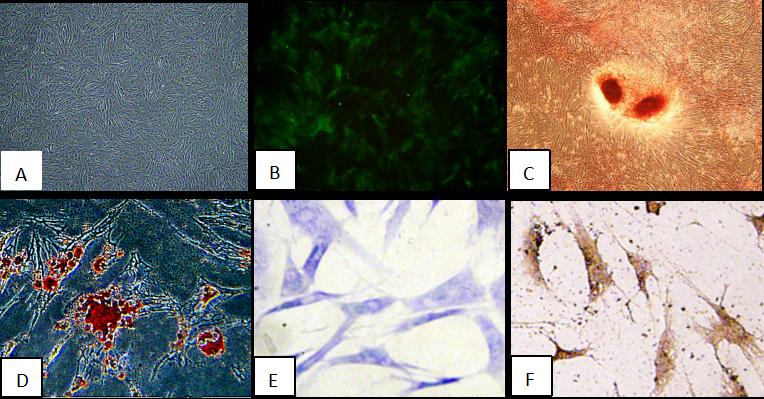
圖1:BMSCs與GFP-BMSCs的特性
2.BMSCs移植對CIA大鼠的干預(yù)作用評估
經(jīng)靜脈輸注BMSCs可改善CIA大鼠關(guān)節(jié)炎癥,延緩CIA大鼠關(guān)節(jié)炎放射學(xué)進(jìn)展��,作用與RA經(jīng)典藥物MTX相似�����。
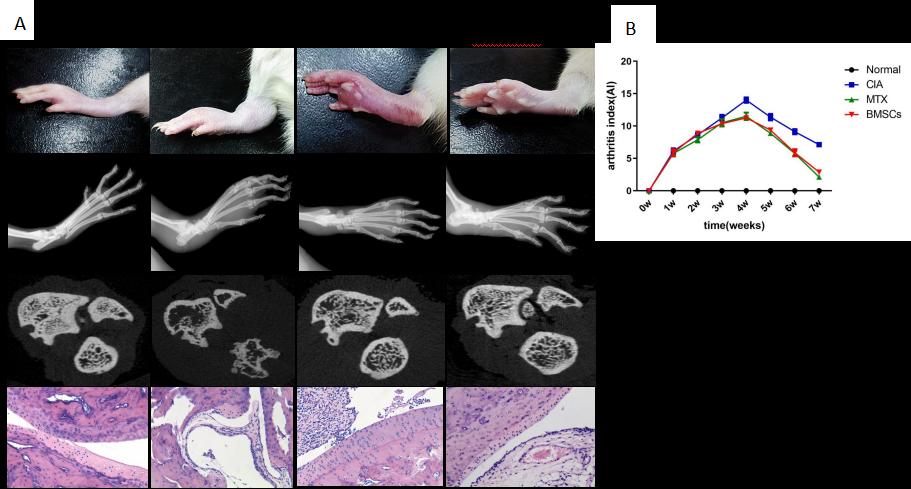
圖2:BMSCs減輕了CIA大鼠的炎癥反應(yīng)����,并抑制其骨破壞
3.BMSCs對CIA大鼠血清及滑膜中趨化因子軸及骨代謝相關(guān)因子表達(dá)的影響:
BMSCs抑制血清CXCL10的表達(dá)(圖3A),并抑制滑膜處CXCL10和CXCR3的表達(dá)(圖3B)。mRNA表達(dá)分析顯示(圖3C)�,BMSCs可能調(diào)節(jié)血清和滑膜組織中RANKL/OPG的表達(dá)水平。

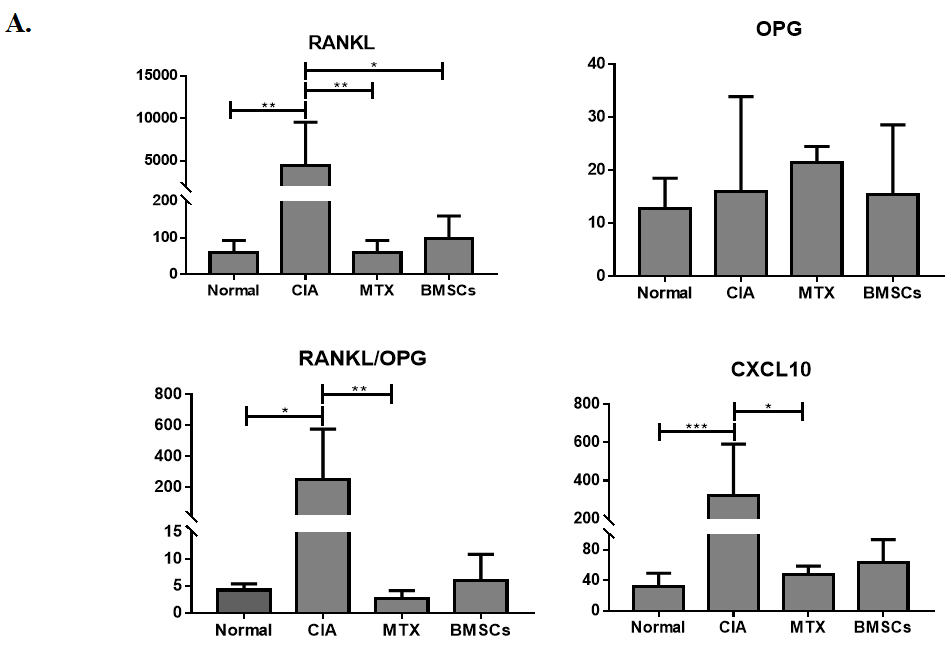
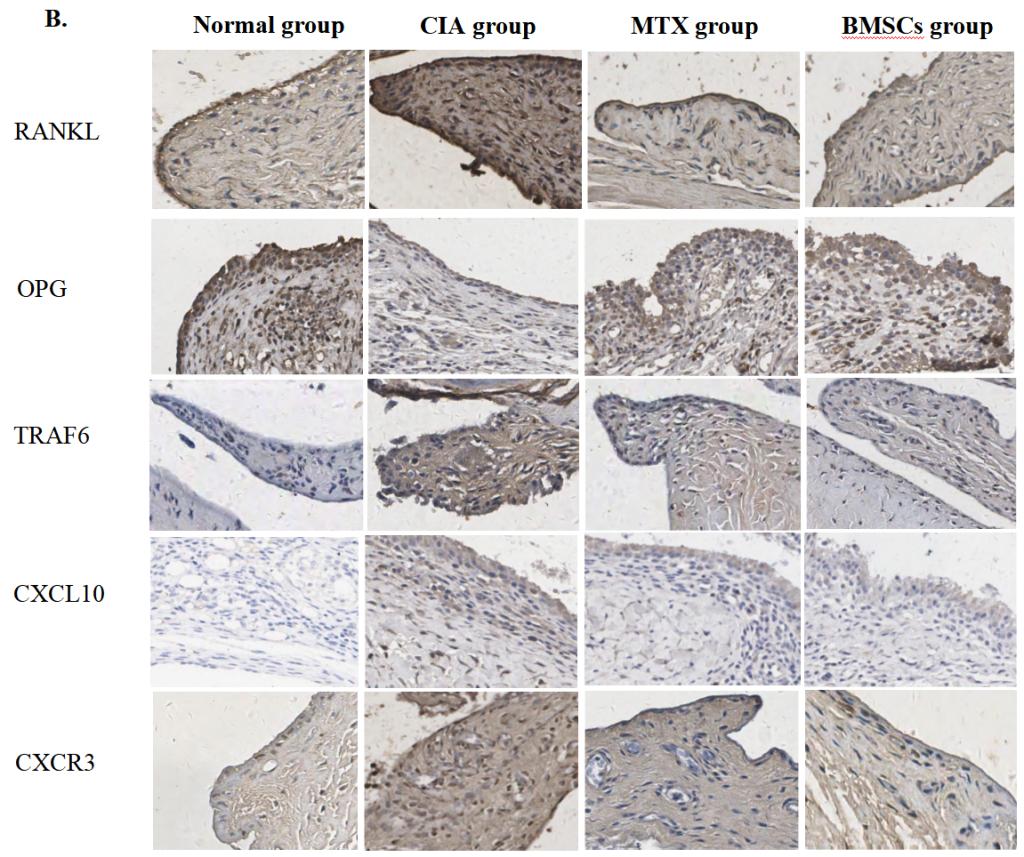
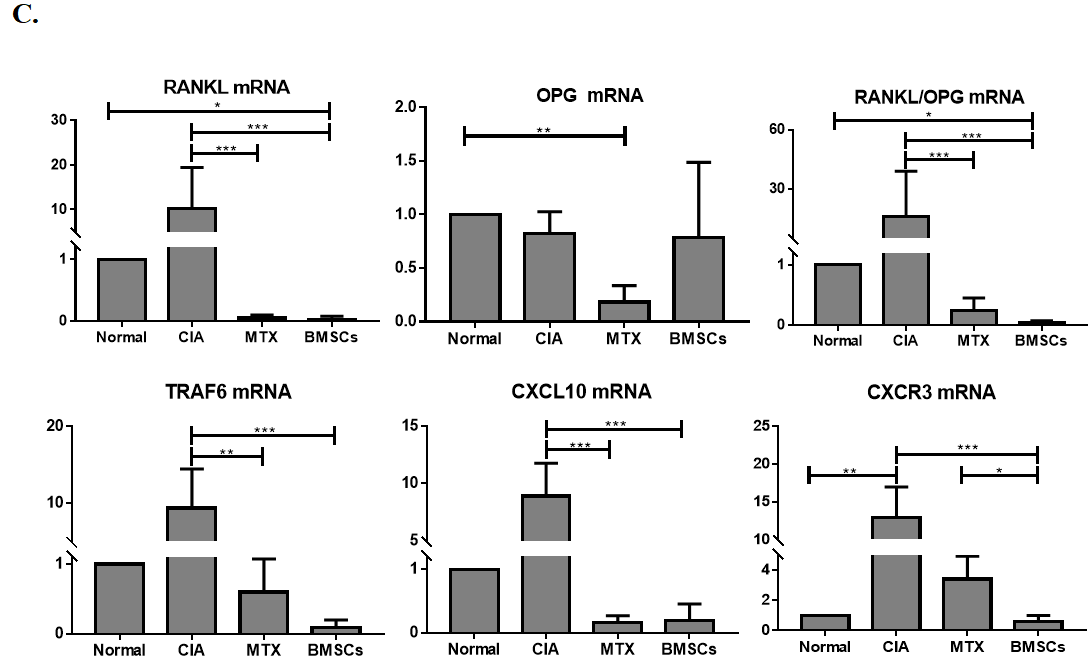
圖3:BMSCs對CIA模型大鼠RANKL/OPG/TRAF6信號通路及CXCL10/CXCR3趨化因子軸的影響
4.CIA大鼠關(guān)節(jié)中GFP-MSCs遷移定植及軟骨細(xì)胞分化的研究
干預(yù)后第3�����、11�����、30和42天���,在CIA模型大鼠后踝關(guān)節(jié)中追蹤GFP-BMSCs。移植3天后�,GFP陽性細(xì)胞主要分布在骨髓和滑膜組織中(圖4A、B����、C),軟骨組織中未觀察到GFP陽性細(xì)胞(圖4D)��。從第11天開始在軟骨中觀察到GFP陽性細(xì)胞����,并逐漸從梭形細(xì)胞轉(zhuǎn)變?yōu)闄E圓形/球形細(xì)胞(圖4E),移植后42 d仍觀察到GFP陽性細(xì)胞(圖4F)�����。抗Ⅱ型膠原免疫熒光染色觀察到關(guān)節(jié)軟骨(尤其是受損軟骨)中有抗Ⅱ型膠原/GFP雙陽性細(xì)胞(圖5)�����。
圖4:GFP-BMSCs移植后3 d在滑膜軟骨和骨髓中的分布
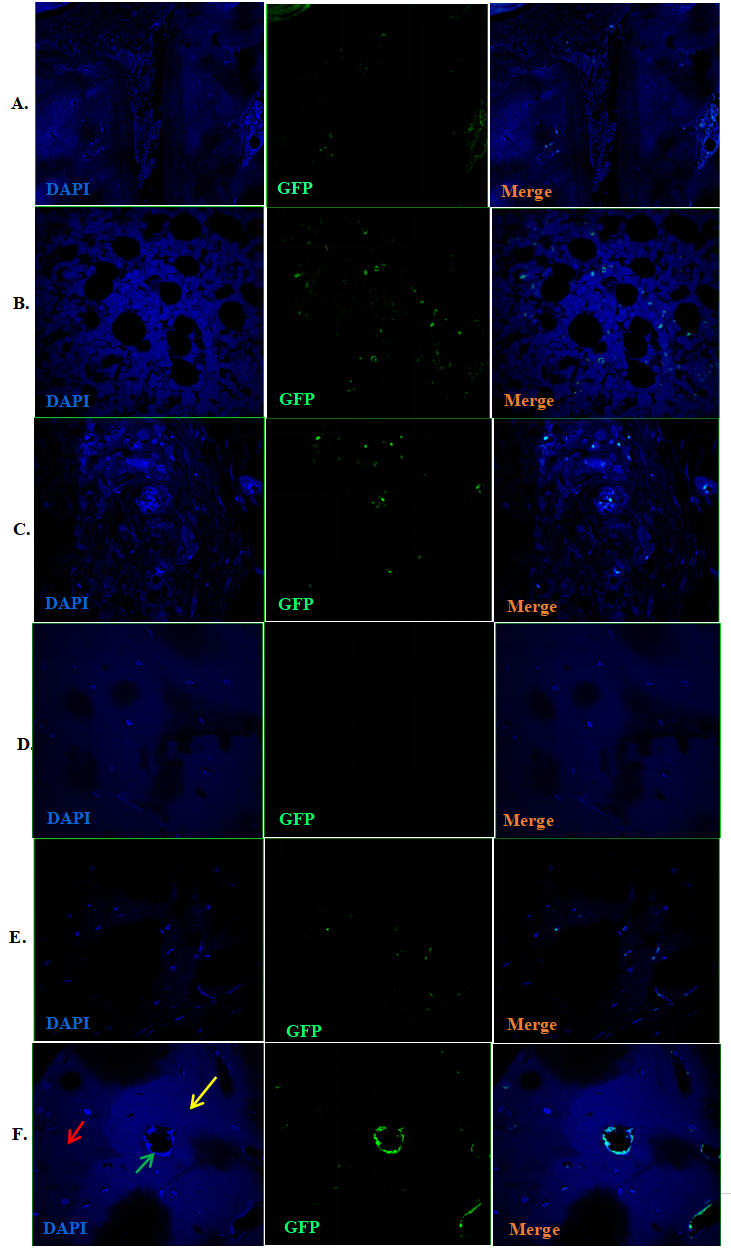
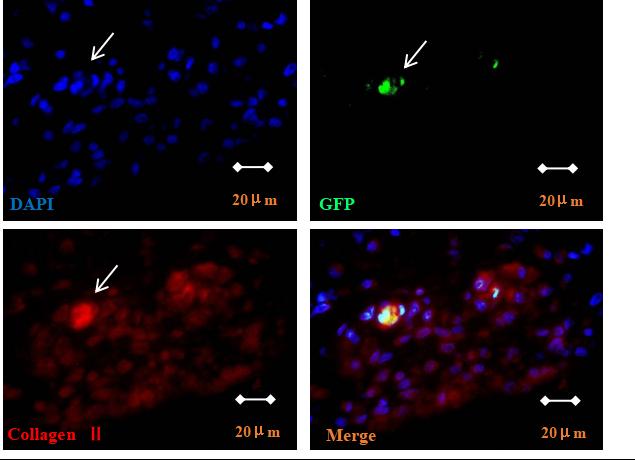


圖5:免疫熒光染色顯示BMSCs在軟骨損傷部位轉(zhuǎn)變?yōu)镚FP/ II型膠原雙陽性細(xì)胞(1000×)

綜上�����,BMSCs可通過抑制CXCL10/CXCR3趨化軸和調(diào)節(jié)RANKL/OPG比值���,并直接分化為軟骨細(xì)胞�����,改善CIA大鼠的骨破壞�����,為BMSCs在RA治療的臨床轉(zhuǎn)化應(yīng)用提供重要依據(jù)�。
張莉蕓教授為本研究的通信作者����,高晉芳為本研究論文的第一作者��,該研究得到國家自然科學(xué)基金�����、山西省科技廳自然科學(xué)基金面上項(xiàng)目的支持�。