我校細(xì)胞生理學(xué)教育部重點(diǎn)實(shí)驗(yàn)室曹濟(jì)民團(tuán)隊(duì)青年教師王德平博士最新的研究成果題為《Silica nanomaterials induce organ injuries by Ca2+-ROS-initiated disruption of the endothelial barrier and triggering intravascular coagulation》(二氧化硅納米材料通過Ca2+- ROS觸發(fā)內(nèi)皮屏障破壞并觸發(fā)血管內(nèi)凝血誘導(dǎo)器官損傷)的科研論文發(fā)表在Top 1區(qū)期刊《Particle and Fibre Toxicology》(影響因子:7.546)�。青年教師王昭君作為本文的共同第一作者,在研究中有重要貢獻(xiàn)���。
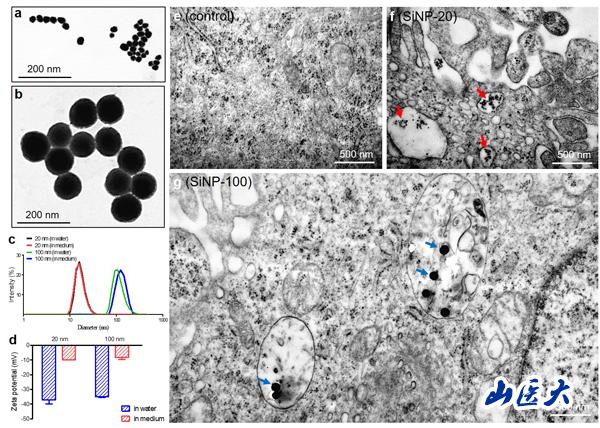
(電鏡下二氧化硅納米顆粒SiNPs形態(tài)及內(nèi)吞作用)
該研究首次報道了二氧化硅納米粒子(SiNPs)在分子�、細(xì)胞和整體水平對內(nèi)皮細(xì)胞的毒性作用及其損傷機(jī)制。該研究針對顆粒直徑為20 nm和100 nm的SiNPs可能造成的不同毒性作用��,在體外培養(yǎng)的人臍靜脈內(nèi)皮細(xì)胞(HUVECs)和成年雌性Balb/c小鼠中進(jìn)行研究���。
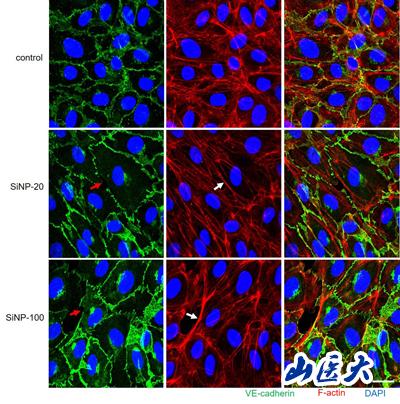
(SiNPs對HUVEC細(xì)胞連接完整性的影響)
在細(xì)胞實(shí)驗(yàn)中��,發(fā)現(xiàn)SiNP-20和SiNP-100均使HUVECs細(xì)胞活力降低��,細(xì)胞膜受損��,并以濃度依賴性的方式抑制HUVECs的遷移和管的形成�����。兩種SiNPs均可誘導(dǎo)顯著的鈣動員和活性氧(ROS)的產(chǎn)生,增加血管內(nèi)皮(VE)-cadherin在酪氨酸731殘基位點(diǎn)(pY731-VEC)的磷酸化��,降低VE-cadherin的表達(dá)��,破壞VE-cadherin的連續(xù)性并誘導(dǎo)F-actin在HUVECs中的重新組裝���。通過YM58483阻斷Ca2+釋放激活Ca2+(CRAC)通道或n -乙酰半胱氨酸(NAC)消除ROS�,可逆轉(zhuǎn)對內(nèi)皮細(xì)胞的損傷。
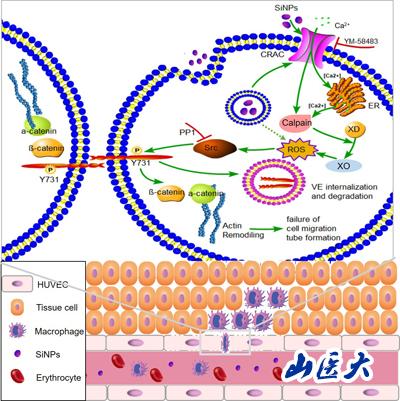
(本研究提出導(dǎo)致SiNPs誘導(dǎo)內(nèi)皮屏障損傷的信號通路示意圖)
在體實(shí)驗(yàn)中��,靜脈注射SiNP-20和SiNP-100均以劑量���、顆粒大小和暴露時間依賴的方式誘導(dǎo)Balb/c小鼠多器官的損傷����。在SiNPs暴露后���,可引起小鼠的多器官損傷�����,包括內(nèi)皮損傷�����、血管內(nèi)凝血和繼發(fā)性炎癥�。在體內(nèi)多器官組織中����,SiNPs降低了VE-cadherin的表達(dá),改變了VE-cadherin的空間分布。
由此說明SiNPs暴露導(dǎo)致的損傷可能是由上游Ca2+-ROS信號通路和下游VE-cadherin磷酸化破壞以及F-actin重構(gòu)所引起�����?���;诒狙芯康陌l(fā)現(xiàn)將有助于更好地理解SiNPs的生物毒性,并開發(fā)相關(guān)的轉(zhuǎn)化途徑��。
(圖文/王昭君)






